耐热钢与高温合金均为金属材料,而金属材料在高温下发生的气体腐蚀主要是氧化,因此耐热钢与高温合金的氧化过程实际上就是它们与氧化性介质反应生成氧化物的过程。
氧化是一种典型的化学腐蚀,它具有介质与金属直接接触而发生化学反应、反应产物可附着在金属表面、反应过程没有电流产生等化学腐蚀的特点。在高温工况条件下,当氧气、二氧化碳、氧化氢及氢气等气体与纯净的金属表面接触时,介质分子就吸附于金属表面并分解成介质原子,然后介质原子与金属原子之间发生化合作用。化合作用的结果首先使钢脱碳(针对于耐热钢),随后使金属氧化(针对于耐热钢和高温合金),其反应可用下式表示:
Me+X=MeX(10.1)
式中,Me代表金属原子;X代表介质原子。
如果腐蚀产物MeX是可挥发气体或以不完整的膜覆盖在金属表面,则介质可以继续与金属表面接触,并按吸附、分解、化合的过程使金属继续氧化。反之,如果腐蚀产物MeX能完整地覆盖在金属表面上,要使氧化过程能够进一步发展,则必须使金属原子或金属离子与氧原子或氧离子的相互迎面扩散,然后相遇并化合成MeX而使氧化膜继续长大。
图10.1是金属氧化时金属原子或金属离子与氧原子或氧离子穿过氧化膜扩散生长的示意图,至于氧化膜的生成区靠近氧化膜的哪一边,则取决于金属原子或金属离子与氧原子或氧离子两者的扩散速率。
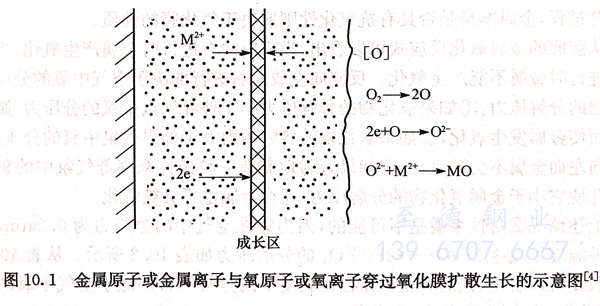
金属原子或金属离子与氧原子或氧离子两者的扩散速率又取决于它们的粒子半径。表10.1给出了部分常见金属与非金属的原子半径和离子半径。
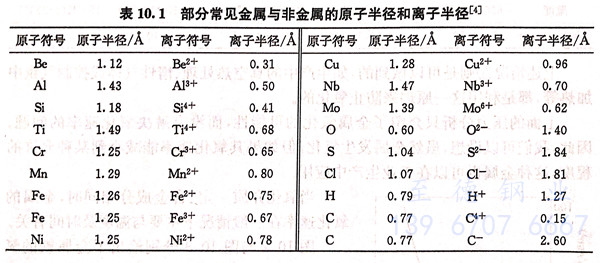
由表10.1可见,金属的离子半径比相应金属的原子半径小,氧化剂的阴离子半径比相应氧化剂的原子半径大。因此,在一般情况下可以推测,从氧化膜内侧向外侧运动的主要是金属离子与电子(而不是原子),而从氧化膜表面向内部扩散的则是氧化剂的阴离子。此时,氧化剂是在氧化膜的外表面依靠穿过氧化膜传运出来的电子而实现离子化。由表10.1还可以看到,金属离子的半径显著地小于氧离子的半径,这说明在相互迎面扩散过程中金属离子的迁移速率较大,因而氧化膜主要在其成长区的外表面上生长。自然,在化学腐蚀过程中离子扩散的假设并不排斥还有原子平行地进行扩散的可能性。
随着氧化膜的增厚,金属离子与氧离子的扩散越来越困难,这时候形成的氧化膜具有抑制金属继续发生氧化的作用。我们把这种具有抑制金属继续发生氧化的氧化膜称为保护膜。金属氧化到一定程度后是否会继续氧化,则取决于氧化膜的性质。
由上可见,氧化膜的形成是化学反应过程,氧化膜的增厚则是扩散和化学反应的综合过程,金属本身是否具有抗氧化性则取决于氧化膜的性质。
从前面的金属氧化反应式可以看出,当反应向右进行时金属产生氧化,当反应向左进行时金属不能产生氧化。反应向左或向右进行取决于空气中氧的分压力和氧化物的分解压力:①. 如果氧化物的分解压力小于外界气氛中氧的分压力,则反应向右而使金属发生氧化;②. 如果氧化物的分解压力大于外界气氛中氧的分压力,则反应向左而金属不会被氧化;③. 如果人为地制造一种条件来降低气氛中的氧的分压力并使它小于金属氧化物的分解压力,那么金属也不会被氧化。

上述情况②对铁来说是不可能的,因为氧在空气中的分压力为0.2atm,而铁在各种温度下发生2FeO→2Fe+O2的分解压力如表10.2所示。从表10.2的这些数据可以看出,铁的氧化物在各种温度下的分解压力都低于空气中氧的分压力,因此铁在高温下是不抗氧化的。
上述情况③则是可以做到的,如生产中的真空热处理、惰性气体或控制气氛中加热等,都是利用这一原理来防止氧化的。
上面的压力分析只介绍了金属氧化的可能性,而没有解决氧化速率的问题。因此,我们可以设想,虽然金属发生氧化,但如果其氧化速率能减小到某种允许的程度,这种金属也可以在工业生产中应用。
当氧化介质一定、合金成分相同时,金属的氧化速率在一般情况下主要与温度及时间有关。
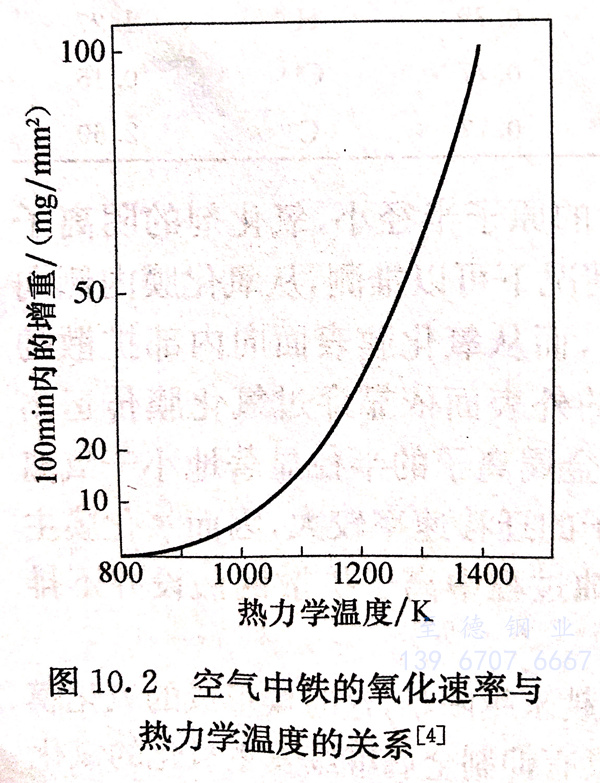
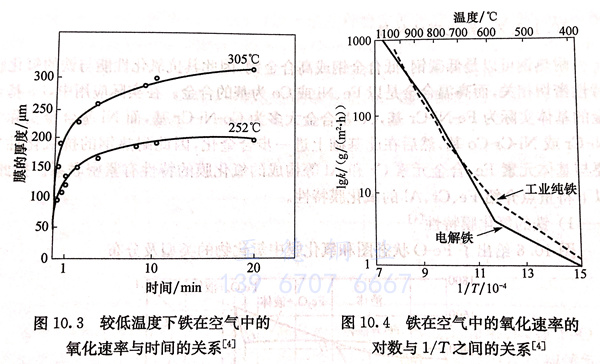
图10.2与图10.3分别给出了金属铁的氧化速率与温度和时间的关系曲线。从图10.2可以看到,铁的氧化速率随着温度升高而明显增大,这是由两方面的原因造成的,一方面是温度升高使氧化反应加快,另一方面是温度升高使扩散加快。而从图10.3却可以看到另一方面的情况,即在252℃或305℃空气中,随着时间的增加,铁的氧化速率增长缓慢,这是由于随着氧化膜的增厚、扩散阻力加大的缘故,但铁的这种效果只能持续到575℃左右。图10.4给出了铁在空气中氧化速率的另一个转变点:850~880℃.在该温度范围内,铁的氧化速率随着温度的上升而缓慢增大,这是铁素体转变为奥氏体而造成,但此温度范围内铁的氧化速率仍然比575℃以下要大得多。
至于氧化速率与时间的关系,则大致可分为如图10.5中直线I、曲线II与曲线III 所示的三种情况:
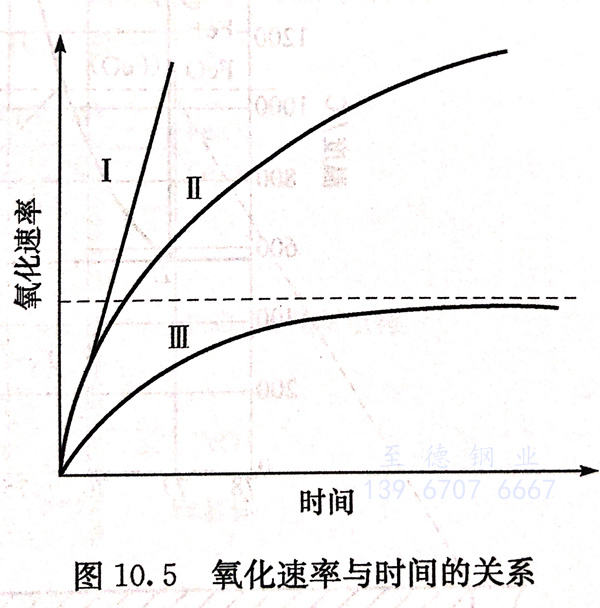
(1) 不生成完整的连续氧化膜,如钾、钠、钙、钡、镁等。它们的氧化速率是恒定的,这时氧化速率与时间之间的关系有图10.5中曲线I所示的直线关系,且可用方程dy/dt=K或y=Kt+A来表示,式中y为氧化膜厚度,t为时间,A、K为常数。
(2)可以生成完整的氧化膜但它不阻碍扩散,这类金属有铁、铜、镍、锰、锆、钛等。这时氧化速率与时间之间的关系遵循图10.5中曲线II所示的抛物线规律,即dy/dt=K/y或y2=Kt+A.
(3)不但可以生成完整的氧化膜,而且它还可以阻碍扩散,如铬、硅、铝等。这时氧化速率与时间之间的关系遵循图10.5中曲线III所示的对数规律(或渐近线规律),即dy/dt=K/e”或y=lnKt。
此外,人们还在一些金属和合金中发现了氧化速率与时间之间的立方规律,在高温合金的涂层上还发现有氧化速率与时间之间的四次方和次方规律。
上面介绍了金属的氧化过程及压力、温度、时间对氧化过程的影响,那么什么样的氧化膜可以抑制氧化过程继续进行,即具有抗氧化性呢?这就需要从分析氧化膜的特性着手。



